Description du projet
Source de nombreuses études, trésor des côtes méditerranéennes, la posidonie est l’objet de toutes les curiosités. Dans une série de 3 volets, nous explorerons les divers aspects de son écologie, de sa biologie, ses services pour l’Homme, les menaces qui pèsent sur elles, ainsi que les solutions pour la protéger.
Texte par Jean-Vincent Vieux-Ingrassia – NaturDive
Posidonia oceanica : une plante marine endémique
Ce végétal marin, endémique de Méditerranée et entièrement protégé, est une plante à fleurs et à fruits et doit son nom à Poséidon, dieu grec des mers et des océans. Son origine est en fait terrestre. Elles ont évolué à partir de plantes de l’ordre des Alismatales, dont font partie les joncs, les sagittaires et les plantains d’eau et sont retournées à l’eau marine, à la manière des cétacés, il y a 80 millions d’années (Les et al., 1997).
La posidonie fait penser aux fougères ou aux trèfles car elle avance dans le sédiment, par des rhizomes, i.e. des tiges rampantes, portant des racines (Boudouresque & Meinesz 1982; Boudouresque & Jeudy de Grissac 1983; Boudouresque et al., 2012). Alors qu’une extrémité avance sans interruption, l’arrière meurt, ce qui a permis de considérer que, théoriquement, un individu, entendez par là le rhizome, est immortel. Il paraîtrait que certains auraient plusieurs millénaires ! Sa croissance est lente, très lente, de 3 à 6 cm par année.
Ce qui la classe parmi les plantes à la croissance la plus lente et à la plus longue durée de vie (Kendrick et al., 2005; Gobert et al., 2007; Arnaud-Haond et al., 2012; Guerrero-Meseguer et al., 2018).
Ses rhizomes sont de deux types : les rampants ou plagiotropes et les dressés ou orthotropes. Ceux-ci sont terminés par des bouquets de 4 à 8 feuilles vertes en lanières d’1cm de large pour presque 80 à 100cm de longueur. La densité des faisceaux peut atteindre plusieurs centaines par mètre carré (Boudouresque et al., 2012; Champenois & Borges 2012; Koopmans et al., 2020). On y retrouve de nombreuses espèces dites épibiontes, passant leur vie accrochées sur ce support biologique (Boudouresque & Meinesz 1982; Boudouresque & Jeudy de Grissac 1983; Pergent-Martini et al., 2005; Gobert et al., 2007; Boudouresque et al., 2016).
Comme ses cousines terrestres, la posidonie perd ses feuilles, principalement en automne, qui iront se déposer sur les plages, à la force des vagues, pour former les fameuses banquettes, agrémentées de quelques aegagropiles. Des pelotes de fibres de posidonie résultantes de la décomposition des feuilles dans l’eau par les courants et la houle. Les fibres s’enroulent autour d’un morceau de rhizome, ou bien un débris, et comme une pelote de fil finissent par former une boule plus ou moins épaisse. Les feuilles s’accumulent également dans l’eau, sur le sédiment, créant des lits de feuilles mortes. Ceux-ci abritent significativement plus d’espèces de poissons que les milieux sableux dépourvus de feuilles. On y retrouve de nombreux sars et rougets, ainsi que des labres et des rombous. Cet habitat change en forme et en taille selon les conditions hydrodynamiques locales, mais demeure une zone d’alimentation spécifique. En effet, les invertébrés y pullulent, ce qui conduit à l’augmentation de la présence de prédateurs fouisseurs et d’opportunistes. Les espèces fouillant sous les feuilles posées au fond de l’eau, les remettent en suspension, diminuant la pénétration de la lumière, ce qui leur sert de cachette. C’est pourquoi de nombreux juvéniles y trouvent également un abri sûr, parfois en adoptant également une livrée mimétique. La combinaison de la réduction de la lumière et des couleurs de camouflage rendent très difficile leur détection par les chasseurs sous-marins et aériens, comme les cormorans (Bussotti et al., 2022).
© Jean-Vincent Vieux-Ingrassia / Ioana Stoicescu / Samuel Jeglot
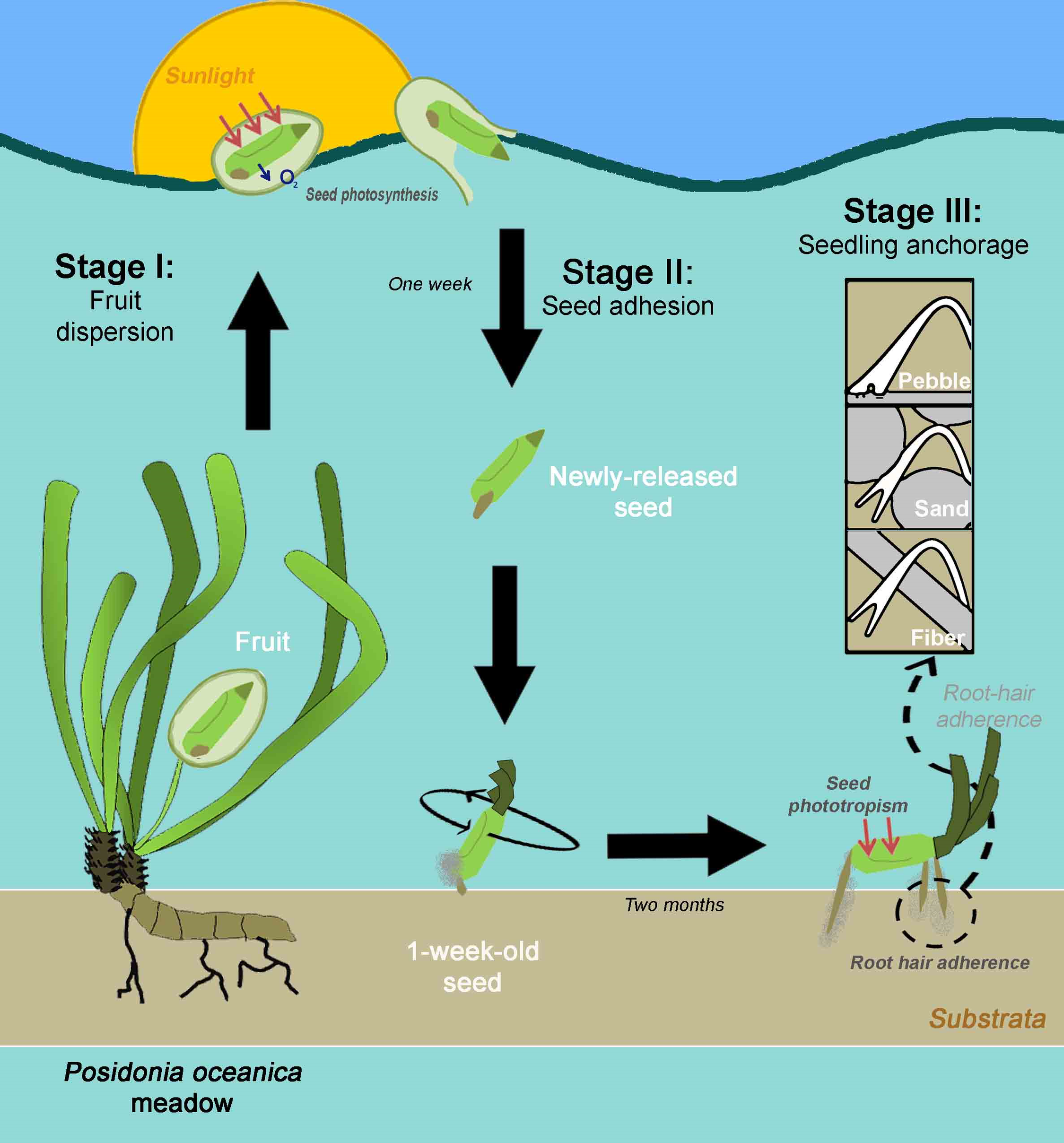
La floraison, quant à elle, a lieu entre août et novembre, tous les 5 à 10 ans, et permet à des fruits brun à vert, appelés olives de mer, de se détacher puis de flotter, pendant une quinzaine de jours, avant de larguer leur unique graine qui germera pour donner un nouvel individu. C’est une espèce hermaphrodite et quand elle fleurit, ce phénomène est massif et coordonné, ce qui permet d’optimiser les chances de germination.
En effet, étant imprévisible et très importante, cette libération soudaine de fruits prend les herbivores à contre pied et sature le milieu de nourriture. Cette technique apporte tellement à manger que les consommateurs ne peuvent pas suivre et en laisse germer un nombre conséquent (Guerrero-Meseguer et al., 2018).
Le développement de la graine va ensuite suivre 3 étapes. D’abord la dispersion dans l’eau où la graine va montrer une activité photosynthétique à l’intérieur du fruit. Puis une adhérence de la graine, une fois sur le fond, qui va développer des poils adhésifs via sa surface et ses premières racines, dites primaires. Enfin, celle-ci va s’ancrer, produire une sorte de trépied avec ses racines primaires et secondaires et va s’orienter face à la lumière (Guerrero-Meseguer et al., 2018).
Les juvéniles vont alors s’accrocher au substrat par des poils absorbants adhésifs, ayant une adaptation apparente à l’exposition aux forts remous du littoral (Badalamenti et al., 2015 ; Borovec & Vohník 2018). La force d’ancrage accordée par ces poils racinaires peuvent atteindre 5,23 Newtons (Borovec & Vohník 2018).
La dissémination de cette espèce est particulièrement efficace puisque des études ont montré la présence de nombreux rhizomes clones distants de 1 à 15 km (Arnaud-Haond et al., 2012). Mais, l’ancrage difficile des jeunes plantules rend son développement complexe. Malgré une reproduction sexuée, la majorité de son développement se fait, en réalité, de manière végétatif, par bouturage (Boudouresque & Meinesz 1982; Boudouresque & Jeudy de Grissac 1983; Arnaud-Haond et al., 2012; Guerrero-Meseguer et al., 2018).
En dessous, dans le sédiment, un autre monde se façonne. Les rhizomes, pratiquement imputrescibles, couplés aux racines et à du sédiment, qui colmate les interstices, forment leur propre sol : la matte. Pouvant atteindre plusieurs mètres d’épaisseur, elle maintient le sédiment au fond et contribue à la survie de nombreux invertébrés comme des vers, crustacés ou encore des mollusques. Cette matte résiste à l’accumulation de sédiments par une croissance verticale, de 10 cm à près d’1 mètre par siècle, conduisant à l’élévation du fond de la mer. Les racines, compactées entre elles, s’enfoncent sur 70 cm, et s’ancrent dans le substrat afin d’y récupérer les nutriments nécessaires (Boudouresque & Meinesz 1982; Boudouresque & Jeudy de Grissac 1983; Kendrick et al., 2005; Pergent-Martini et al., 2005; Gobert et al., 2007; Boudouresque et al., 2012; Boudouresque et al., 2016).
Pour retirer les nutriments du substrat, les poils racinaires adhésifs, présents au stade juvénile, vont laisser place à une colonisation par des mycorhizes au niveau des parties terminales des racines. On assiste alors à la mise en place d’une symbiose racine-champignon (Borovec & Vohník 2018). On peut donc fortement imaginer que ceux-ci permettent un meilleur afflux de nutriments, une facilitation, entre le substrat/matte et la plante, comme chez les espèces terrestres. N’oublions pas que la posidonie fut terrestre avant d’être marine, cette hypothèse n’est donc pas dénuée de sens. De plus, en 2021, des chercheurs ont découvert la présence d’une bactérie endosymbiotique, Candidatus Celerinatantimonas neptuna, vivant à l’intérieur des tissus racinaires de la posidonie, où elle fournit de l’ammoniac et des acides aminés en échange de sucres (Mohr et al. 2021).
En 2023, l’étude des aegagropiles, les pelotes de posidonie, a permis de confirmer que les fibres qui les composent sont bien issues de la dégradation de la Posidonie (Lefebvre, Compère & Gobert 2023). Plus précisément, ces fibres sont issues des bases des feuilles et des rhizomes. L’étude a également permis de comprendre comment les fibres étaient générées. L’association racine-champignon ne se limite pas seulement à la vie de la plante. Ce sont en effet ces mêmes champignons endophytes (Posidoniomyces atricolor), vivants à l’intérieur des tissus, qui sont responsables, en majeure partie, de la production de ces fibres. Les chercheurs conclut ainsi : « Cette étude montre que la prolifération des champignons provoque une dégradation des organes chez la Posidonie, commençant tôt dans les plantes vivantes de P. oceanica, se poursuivant dans la matte et, probablement, dans la litière de feuilles. Ce champignon endophyte joue un rôle bien plus important que celui d’un simple endosymbionte au sein d’un végétal ; son omniprésence au sein de P. oceanica (et la dégradation de la lamelle médiane et la mort cellulaire lors de la prolifération), entraînant la dégradation de divers organes de Posidonia, contribue également à l’enrichissement du compartiment « matte » de cet écosystème, favorisant notamment la rétention d’azote dans ses parois chitineuses . »
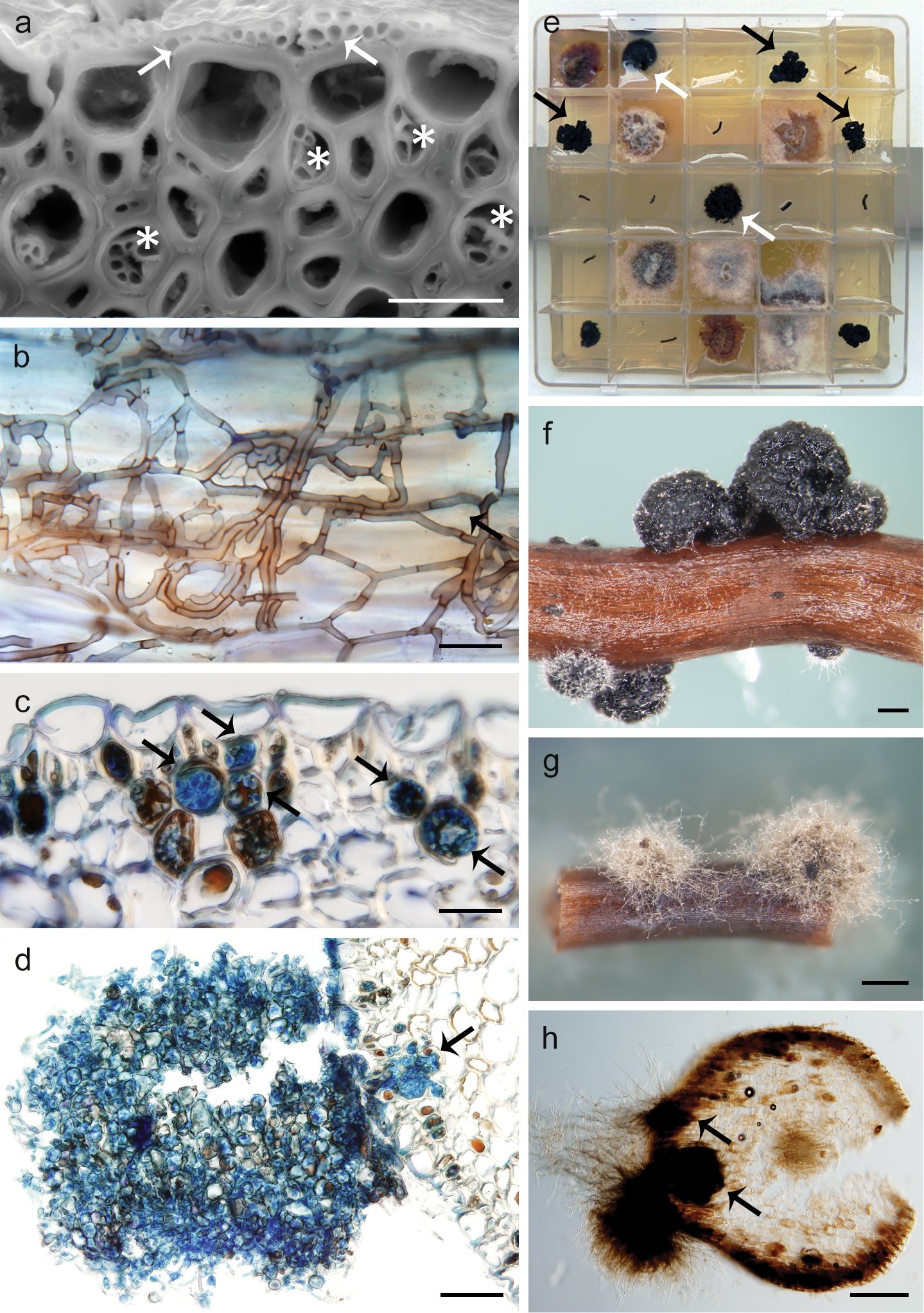
Ci contre : Schéma de colonisation racinaire in vivo et aspects culturels in vitro de Posidoniomyces atricolor. A. La colonisation in vivo sur la surface racinaire (flèches) et dans l’hypoderme (astérisques) de P. oceanica B. Colonisation DSE sur la surface racinaire C. Microsclérotes en germination colorés au bleu trypan (flèches) D. Colonie compacte développée à partir de microsclérotes (flèche) E. Segments racinaires stérilisés en surface produisant des colonies compactes de P. atricolor (flèches noires), parfois avec du mycélium de substrat (flèches blanches) F. Morphotype colonial compact G. Morphotype colonial mycélien H. Morphotype mycélien se développant à partir de microsclérotes (flèches) en coupe transversale. Barres d’échelle : 20 µm (a, b), 50 µm (c), 100 µm (d), 200 µm (f, h), 500 µm (g). – © Vohník et al. 2019
Dans de très rares cas, la matte est si importante, l’élévation si haute, que les feuilles de posidonie affleurent l’eau créant un véritable récif barrière, ou récif frangeant. On en retrouve à Port-Cros et dans des baies abritées comme au niveau de la côte Nord de l’île Sainte-Marguerite. Effectivement, dans des conditions calmes et des eaux relativement peu profondes, près du rivage, la posidonie peut pousser verticalement, émerger partiellement de la surface et finalement former ces fameux récifs. Cela a tendance à se produire de façon parallèle à la côte, laissant une zone abritée entre le rivage et la barrière : la zone d’arrière-récif en eau peu profonde, isolant un lagon (Bonhomme et al., 2015; Hachani et al., 2016). La formation de la matte est particulièrement dépendante de la vitesse de dépôts des sédiments. En effet, une sédimentation trop rapide étouffe les rhizomes et une trop faible empêche un bon ancrage et peut causer le détachement de l’individu (Boudouresque & Jeudy de Grissac 1983; Boudouresque et al., 2015).
© Christophe Chellapermal / Samuel Jeglot
Cette espèce structurale manque de concurrents indigènes et de grands prédateurs dans l’habitat marin littoral qu’elle occupe, entre 0 et 40 m de profondeur selon les régions, ce qui conduit au développement de vastes prairies monospécifiques, c’est-à-dire qu’elle domine l’espace (Boudouresque et al., 2012; Telesca et al., 2015). Par ailleurs, elle est une espèce ‘sentinelle’ car elle est exigeante en terme de qualité du milieu de vie et une régression de sa surface implique un changement néfaste de l’environnement, comme un apport de polluants ou une agression mécanique par ancre de bateaux. Elle sert donc d’indicateur de la bonne santé du milieu marin littoral (Pergent-Martini et al., 2015). Bien qu’elle puisse survivre dans une large gamme de salinité et de température de l’eau, elle a néanmoins besoin d’une eau claire avec une faible turbidité, d’où son absence près des deltas des grands fleuves comme le Nil ou le Rhône (Meinesz et al., 2009; Tomasello et al., 2009; Houngnandan 2020) Aux dernières estimations, la distribution spatiale des herbiers de Posidonia oceanica a été évaluée à environ 12 247 km², soit 0,005 % de la Méditerranée, bien que des portions substantielles des côtes n’ont pas été réellement cartographiées. De ce constat, certains chercheurs estiment la surface réelle dans une tranche entre 25 000 et 50 000 km², soit 1 à 2 % de la Méditerranée. À noter, qu’elle est un peu plus présente dans le bassin Est que dans le bassin Ouest : 58,3 % contre 41.7% du total estimé (Telesca et al., 2015).
La répartition actuelle de P. oceanica (zones vertes) le long du littoral de la Mer Méditerranée, sur la base des informations spatiales rassemblées disponibles sur la présence des herbiers. Carte créée avec le logiciel ArcGIS® par Esri (Environmental Systems Resource Institute, ArcMap 9.3, www.esri.com) à partir des données d’OpenStreetMap.org (© Contributeurs d’OpenStreetMap59). © Telesca & al. (2015).
Le saviez-vous ? Sa présence en Méditerranée est d’autant plus miraculeuse que la posidonie a survécu à la crise de salinité Messinienne, il y a 5 millions d’années. À cette époque, le détroit de Gibraltar s’est refermé et en 1500 ans à peine, la Méditerranée s’est quasiment entièrement asséchée, ne laissant que quelques lacs salés cernés par de profonds canyons (Hsü et al., 1977). Ce désastre va durer 300 000 ans ! La posidonie est une miraculée.
Un réservoir de biodiversité
Les capacités de la posidonie à moduler la biodisponibilité des ressources pour d’autres espèces, et donc de changer le milieu où elle vit pour créer un nouveau milieu qui lui est spécifique, fait d’elle une espèce dite « ingénieure ». Sa vie structure le milieu afin de fonder un écosystème à part entière (Boudouresque & Meinesz 1982; Boudouresque & Jeudy de Grissac 1983; Kendrick et al., 2005; Pergent-Martini et al., 2005; Gobert et al., 2007; Boudouresque et al., 2015). C’est pourquoi, la biocénose, c’est-à-dire l’ensemble du vivant d’un milieu donné, associée à l’herbier est la plus complexe de la Méditerranée et est à la base de la richesse des eaux dites littorales, en opposition aux eaux du large, dites pélagiques (Boudouresque & Meinesz 1982; Clarke et al., 1998). Étant une espèce créatrice d’habitat, elle héberge donc une biodiversité spécifique importante, près de 400 espèces différentes de végétaux et d’animaux. Les milieux marins n’ayant pas de frontière imperméable, c’est en réalité 2000 espèces qui se côtoient dans cet environnement, la plupart étant de passage et venant d’autres écosystèmes comme les fonds rocheux ou sableux. À leur échelle, l’herbier offre une variété d’abris et une complexité d’habitats comparable à une forêt. Du sol à la canopée, une pléiade d’espèces interagissent (Francour 1997; Guidetti 2000; Kalogirou et al., 2010).
Les producteurs primaires, i.e. les espèces photosynthétiques, sont de trois types. Premièrement, l’herbier en tant que tel, comprenez les feuilles, rhizomes et racines, sont généralement faiblement consommés par les herbivores en raison des défenses structurelles et chimiques. Deuxièmement, les épibiontes foliaires, principalement des cyanobactéries, des algues brunes et rhodobiontes, i.e. algues rouges, qui sont bien plus appréciés car plus savoureuses. Et troisièmement, les épibiontes de rhizomes qui comprennent des chlorobiontes, i.e. algues vertes, peu appétissantes et des algues rouges calcaires comme Peyssonnelia spp. (Boudouresque et al., 2015). De nombreuses algues vont donc pousser directement sur les feuilles ou sur les rhizomes, mais également des animaux comme le bryozoaire Electra posidoniae, le ver plat Comoplana palmula, l’hydraire Sertularia perpusilla ou encore l’actinie Paractinia striata, cousine des anémones.
D’autres, plus mobiles, vont s’y développer, comme des gastéropodes des genres Risso spp. ou Bittium spp. ou bien le crustacé Synischia hectica qui va se nourrir de la feuille elle-même. D’autres phytophages se croisent tel que le bien connu oursin comestible Paracentrotus lividus, ou la saupe Sarpa salpa, poisson herbivore par excellence. Ces herbivores, petits et grands, sont traqués par des prédateurs spécialisés en camouflage dans les feuilles de posidonies comme le labre vert Labrus viridis, le serran-écriture Serranus scriba, le sublet Symphodus rostratus ou bien encore l’étrange siphonostome Syngnathus typle, qui se confond avec des feuilles épaves. D’autres prédateurs, de passage, rôdent également, tels que le poulpe Octopus vulgaris, la murène commune Muraena helena, le congre Conger conger, l’étoile de mer rouge Echinaster sepositus, la dorade royale Sparus aurata et les différentes espèces de sars Diplodus spp. Outre les consommateurs de végétaux et d’animaux, la posidonie héberge aussi des espèces filtreuses, qui nettoient les eaux, ainsi que des espèces nettoyeuses de sédiments. On y retrouve les concombres de mer Holothuria spp., des éponges comme Aphysina aerophoba et Crambe crambe, des vers polychètes comme les spirographes Sabella spallanzanii, ou les superbes mollusques nacres Pinna rudis et Pinna nobilis. Cette dernière peut mesurer jusqu’à 1m20 de haut et est classée en danger critique d’extinction, suite à un phénomène de parasitisme massif mortel (Vázquez-Luis et al., 2017; Carella et al., 2019).
La nuit, la posidonie constitue également un formidable dortoir à certaines espèces de pleine eau comme les abondantes castagnoles Chromis chromis. Cette biodiversité est due en partie par les caractéristiques de la canopée des herbiers, tels que l’ombrage, le déroutement des courants et l’augmentation de la surface du substrat par le feuillage. Ces raisons déterminent une diversité et une abondance accrue de poissons dans les habitats d’herbiers de posidonie, certaines études ont même démontré une saisonnalité dans ces peuplements (Guidetti 2000; Deudero et al., 2008).
Merci aux contributeurs photographiques : Samuel Jeglot, Ioana Stoicescu, Stéphane Jamme & Christophe Chellapermal
Bibliographie
Publications scientifiques
– Agawin N. S. R., Sunyer-Caldù A., Diaz-Cruz M., Frank-Comas A., Garcia-Marquez M. G. & Tovar-Sanchez A. (2022) Mediterranean seagrass Posidonia oceanica accumulates sunscreen UV filters. Marine Pollution Bulletin, Vol 176, https://doi.org/10.1016/j.marpolbul.2022.113417.
– Allison G. W., Lubchenco J. & Carr M. H. (1998) Marine reserves are necessary but not sufficient for marine conservation. Ecological Application 8 (1), 79–92.
– Aragonès L., Garcia-Barba J., Garcia-Bleda E., Lopez I. & Serra J. C. (2015) Beach nourishment impact on Posidonia oceanica : Case study of Poniente Beach (Benidorm, Spain). Ocean Engineering, 107, 1-12.
– Arnaud-Haond S., Duarte C. M., Diaz-Almela E., Marbà N., Sintes T. & Serrao E. A. (2012) Implications of Extreme Life Span in Clonal Organisms: Millenary Clones in Meadows of the Threatened Seagrass Posidonia oceanica. PLoS ONE 7(2): e30454. doi:10.1371/journal.pone.0030454
– Badalamenti F., Alagna A. & Fici S. (2015) Evidences of adaptive traits to rocky substrates undermine paradigm of habitat preference of
the Mediterranean seagrass Posidonia oceanica. Sci. Rep. 5, 8804.
– Balestri E., Piazzi L. & Cinelli F. (1998) Survival and growth of transplanted and natural seedlings of Posidonia oceanica (L.) Delile in a damaged coastal area. J. Exp. Mar. Biol. Ecol, 228 : 209 –225.
– Balestri E., Vallerini F. & Lardicci C. (2010) Storm-generated fragments of the seagrass Posidonia oceanica from beach wrack –A potential source of transplants for restoration. Biological Conservation, 144, 1644-1654.
– Bonhomme D., Boudouresque C. F., Astruch P., Bonhomme J., Bonhomme P., Goujard A. & Thibaut T. (2015) Typology on the reef formations of the Mediterranean seagrass Posidonia oceanica, and the discovery of extensive reefs in the Gulf of Hyères (Provence, Mediterranean). Sci. Rep. Port-Cros natl. Park, 29 : 41-73.
– Borovec O. & Vohník M. (2018) Ontogenetic transition from specialized root hairs to specific root-fungus symbiosis in the dominant Mediterranean seagrass Posidonia oceanica. Scientific Report, 8 : 10773. DOI:10.1038/s41598-018-28989-4
– Boudouresque C. F. & Meinesz A. (1982) Découverte de l’herbier de Posidonie. Cahiers Parc National de Port-Cros 4, 79.
– Boudouresque C. & Jeudy de Grissac A. (1983) L’herbier à Posidonia oceanica en Méditerranée: les interactions entre la plante et le sédiment = Posidonia oceanica seabed in Mediterranean Sea; interactions between plant and sediments. J. Rech. Oceanographic 8, 99–122.
– Boudouresque C.F., Bernard G., Pergent G., Shili A. & Verlaque M. (2009) Regression of Mediterranean seagrasses caused by natural processes and anthropogenic disturbances and stress: A critical review. Bot. Mar. 52, 395–418. https://doi.org/10.1515/BOT.2009.057
– Boudouresque C.F., Bernard G., Bonhomme P., Charbonnel E., Diviacco G., Meinesz A., Pergent G., Pergent-Martini C., Ruitton S. & Tunesi L. (2012) Protection and conservation of Posidonia oceanica meadows. RAMOGE and RAC/SPA.
– Boudouresque C. F., Pergent G. & Pergent-Martini C., et al. (2015) The necromass of the Posidonia oceanica seagrass meadow: fate, role, ecosystem services and vulnerability. Hydrobiologia 781, 25–42. https://doi.org/10.1007/s10750-015-2333-y
– Boudouresque C.-F., Blanfuné A., Pergent G. & Thibaut T. (2021) Restoration of Seagrass Meadows in the Mediterranean Sea: A Critical Review of Effectiveness and Ethical Issues. Water, 13, 1034. https://doi.org/10.3390/w13081034
– Bruno M & Webster C. (2019) MedPAN et SPA/RAC. Le statut 2016 des aires marines protégées de Méditerranée. Ed SPA/RAC & MedPAN. Tunis, 222 pages.
– Bunuel X., Alcoverro T., Romero J., Arthur R., Ruiz J. M., Pérez M., Ontoria Y., Raventos N., Macpherson E., Torrado H. & Pagès J. F. (2020) Warming intensifies the interaction between the temperate seagrass Posidonia oceanica and its dominant fish herbivore Sarpa salpa. Marine Environmental Research, 165, 105237.
– Buonocore E., Donnarumma L., Appolloni L., Miccio A., Russo G. F. & Franzese P. P. (2020) Marine natural capital and ecosystem services: An environmental accounting model, Ecological Modelling, Vol 424, 109029, ISSN 0304-3800, https://doi.org/10.1016/j.ecolmodel.2020.109029.
– Bussotti S., Guidetti P. & Rossi F. (2022) Posidonia oceanica wrack beds as a fish habitat in the surf zone, Estuarine, Coastal and Shelf Science, Volume 272, 107882, ISSN 0272-7714, https://doi.org/10.1016/j.ecss.2022.107882.
– Campagne C. S., Salles J-M. Boissery P. & Deter J. (2015) The seagrass Posidonia oceanica: Ecosystem services identification and economic evaluation of goods and benefits. Mar. Pollut. Bull. http://dx.doi.org/10.1016/j.marpolbul.2015.05.061
– Carella F., Aceto S., Pollaro F., Miccio A., Iaria C., Carrasco N., Prado P. & De Vico G. (2019) A mycobacterial disease is associated with the silent mass mortality of the pen shell Pinna nobilis along the Tyrrhenian coastline of Italy. Sci Rep 9, 2725. https://doi.org/10.1038/s41598-018-37217-y
– Champenois W. & Borges A. V. (2012) Seasonal and interannual variations of community metabolism rates of a Posidonia oceanica seagrass meadow, Limnology and Oceanography, 57, doi: 10.4319/lo.2012.57.1.0347.
– Champenois W. & Borges A. V. (2019) Inter‐annual variations over a decade of primary production of the seagrass Posidonia oceanica. Limnol Oceanogr, 64: 32-45. https://doi.org/10.1002/lno.11017
– Coll M., Piroddi C., Albouy C., Ben Rais Lasram F., Cheung W.W.L., Christensen V., Karpouzi V.S., Guilhaumon F., Mouillot D., Paleczny M., Palomares M.L., Steenbeek J., Trujillo P., Watson R. & Pauly D. (2012) The Mediterranean Sea under siege: Spatial overlap between marine biodiversity, cumulative threats and marine 171 | P a g e reserves. Glob. Ecol. Biogeogr. 21, 465–480. https://doi.org/10.1111/j.1466- 8238.2011.00697.x
– Descamp P., Cornu T., Bougerol M., Boissery P., Ferlat C., Delaruelle G., Deter J. & Gobert S. (2017) Experimental transplantation of Posidonia oceanica. In Proceedings of the 13th International MEDCOAST Congress on Coastal and Marine Sciences, Engineering, Management and Conservation, Mellieha, Malta, 31 October–4 November 2017; Ozhan, E., Ed.; Mediterranean Coastal Foundation: Ortaca, Turkey.
– Deudero S., Morey G., Frau A., Moranta J. & Moreno I. (2008) Temporal trends of littoral fishes at deep Posidonia oceanica seagrass meadows in a temperate coastal zone, Journal of Marine Systems, Vol 70, Issues 1–2, Pages 182-195, ISSN 0924-7963, https://doi.org/10.1016/j.jmarsys.2007.05.001.
– Díaz-Almela E., Marbà N., Álvarez E., Santiago R., Holmer M., Grau A., Mirto S., Danovaro R., Petrou A. & Argyrou M. (2008) Benthic input rates predict seagrass (Posidonia oceanica) fish farm induced decline. Marine Pollution Bulletin 56 (7), 1332-1342. http://dx.doi.org/10.1016/j.marpolbul.2008.03.022.
– Duarte C.M. (2002) The future of seagrass meadows. Environ. Conserv. 29, 192–206. https://doi.org/10.1017/S0376892902000127
– Fernández Torquemada Y., González-Correa J. M., Mártinez J. E. & Sánchez-Lizaso J. L. (2005) Evaluation of the effects produced by the construction and expansion of marinas on Posidonia oceanica (L.) Delile meadows. J Coast Res 49: 94–99.
– Frederiksen M. S., Holmer M., Díaz-Almela E., Marba N. & Duarte C. M. (2007) Sulfide invasion in the seagrass Posidonia oceanica at Mediterranean fish farms: assessment using stable sulfur isotopes. Marine Ecology Progress Series 345, 93-104. http://dx.doi.org/10.3354/meps06990.
– Francour P. (1997) Fish Assemblages of Posidonia oceanica Beds at Port‐Cros (France, NW Mediterranean): Assessment of Composition and Long‐Term Fluctuations by Visual Census. Marine Ecology, 18: 157-173. https://doi.org/10.1111/j.1439-0485.1997.tb00434.x
– Francour P., Harmelin J. G., Pollard D. & Sartoretto S. (2001) A review of marine protected areas in the northwestern Mediterranean region: siting, usage, zonation and management. Aquatic Conservation: Marine and Freshwater Ecosystems 11, 155–188.
– Gacia E. & Duarte C. M. (2001) Sediment Retention by a Mediterranean Posidonia oceanica Meadow: The Balance between Deposition and Resuspension, Estuarine, Coastal and Shelf Science, Volume 52, Issue 4, 2001, Pages 505-514, ISSN 0272-7714, https://doi.org/10.1006/ecss.2000.0753.
– Gaylord B., Kroeker K.J., Sunday J.M., Anderson K.M., Barry J.P., Brown N.E., Connell S.D., Dupont S., Fabricius K.E., Hall-Spencer J.M., Klinger T., Milazzo M., Munday P.L., Russell B.D., Sanford E., Schreiber S.J., Thiyagarajan V., Vaughan M.L.H., Widdicombe S. & Harley C.D.G. (2015) Ocean acidification through the lens of ecological theory. Ecology 96, 3–15. https://doi.org/10.1890/14-0802.1
– Gobert S., Cambridge M. T., Velimirov B., Pergent G., Lepoint G., Bouquegneau J.-M., Dauby P., Pergent-Martini C. & Walker D. I. (2007) Biology of Posidonia. In: seagrasses: biology, ecologyand conservation. Springer, Dordrecht, pp 387-408, https://doi.org/10.1007/978-1-4020-2983-7_17
– González-Correa J. M., Sempere J. T. B., Sánchez-Jerez P., Valle C. (2007) Posidonia oceanica meadows are not declining globally. Analysis of population dynamics in marine protected areas of the Mediterranean Sea. Mar. Ecol. Prog. Ser. 2007, 336, 111–119.
– González-Correa J. M., Fernández-Torquemada Y. & Sánchez-Lizaso J. L. (2008) Long-term effect of beach replenishment on natural recovery of shallow Posidonia oceanica meadows. Estuarine, Coastal and Shelf Science, 76, 834-844.
– González-Correa J. M., Fernández-Torquemada Y. & Sánchez-Lizaso J. L. (2009) Short-term effect of beach replenishment on a shallow meadow. Marine Environmental Research, Elsevier, 68 (3), pp.143.
– Guala I., Simeone S., Buia M. C., Flagella S., Baroli M. & De Falco G. (2006) Posidonia oceanica ‘banquette’ removal: Environmental impact and management implications. Biol. Mar. Mediterr. 13: 149–153.
– Guerrero-Meseguer L., Sanz-Lázaro C. & Marín A. (2018) Understanding the sexual recruitment of one of the oldest and largest organisms on Earth, the seagrass Posidonia oceanica. PLoS One 13, e0207345. https://doi.org/10.1371/journal.pone.0207345
– Guerrero-Meseguer L., Marín A. & Sanz-Lázaro C. (2020) Heat wave intensity can vary the cumulative effects of multiple environmental stressors on Posidonia oceanica seedlings. Marine Environmental Research, 159, 105001.
– Guidetti P. (2000) Differences Among Fish Assemblages Associated with Nearshore Posidonia oceanica Seagrass Beds, Rocky–algal Reefs and Unvegetated Sand Habitats in the Adriatic Sea, Estuarine, Coastal and Shelf Science, Vol 50, Issue 4, Pages 515-529, ISSN 0272-7714, https://doi.org/10.1006/ecss.1999.0584.
– Hachani M. A., Ziadi B., Langar H., Sami D. A., Turki S. & Aleya L. (2016) The mapping of the Posidonia oceanica (L.) Delile barrier reef meadow in the southeastern Gulf of Tunis (Tunisia), Journal of African Earth Sciences, Volume 121, Pages 358-364, ISSN 1464-343X, https://doi.org/10.1016/j.jafrearsci.2016.05.030.
– Holmer M., Pérez M. & Duarte C. M. (2003) Benthic primary producers––a neglected environmental problem in Mediterranean maricultures? Marine Pollution Bulletin 46 (11), 1372-1376. http://dx.doi.org/10.1016/S0025-326X(03)00396-5.
– Holmer M., Argyrou M., Dalsgaard T., Danovaro R., Diaz-Almela E., Duarte C. M., Frederiksen M., Grau A., Karakassis I. & Marbà N. (2008) Effects of fish farm waste on Posidonia oceanica meadows: synthesis and provision of monitoring and management tools. Marine Pollution Bulletin 56 (9), 1618-1629. http://dx.doi.org/10.1016/j.marpolbul.2008.05.020.
– Houngnandan F. (2020) Impact des pressions anthropiques et de l’environnement sur les herbiers de Posidonia oceanica en Méditerranée française, Thèse en écologie biodiversité, Unité de recherche ISEM et MARBEC.
– Houngnandan F., Kéfi S. & Deter J. (2020) Identifying key-conservation areas for Posidonia oceanica seagrass beds, Biological Conservation, Volume 247, https://doi.org/10.1016/j.biocon.2020.108546.
– Hsü K., Montadert L., Bernoulli D., Bianca Cita M., Erickson A., Garrison R. E., Kidd R. B., Mèlierés F., Müller C. & Wright R. (1997) History of the Mediterranean salinity crisis. Nature 267, 399–403. https://doi.org/10.1038/267399a0
– Jackson E. L., Rees S. E., Wilding C. & Attrill, M.J. (2015) Use of a seagrass residency index to apportion commercial fishery landing values and recreation fisheries expenditure to seagrass habitat service. Conservation Biology, 29: 899 909. https://doi.org/10.1111/cobi.12436
– Kalogirou S., Corsini‐Foka M., Sioulas A., Wennhage H. & Pihl L. (2010) Diversity, structure and function of fish assemblages associated with Posidonia oceanica beds in an area of the eastern Mediterranean Sea and the role of non‐indigenous species. Journal of Fish Biology, 77: 2338-2357. https://doi.org/10.1111/j.1095-8649.2010.02817.x
– Katsanevakis S., Wallentinus I., Zenetos A., Leppäkoski E., Çinar M.E., Oztürk B., Grabowski M., Golani D. & Cardoso A.C. (2014) Impacts of invasive alien marine species on ecosystem services and biodiversity: A pan-European review. Aquat. Invasions 9, 391–423. https://doi.org/10.3391/ai.2014.9.4.01
– Kendrick G. A., Marbà N. & Duarte C. M. (2005) Modelling formation of complex topography by the seagrass Posidonia oceanica, Estuarine, Coastal and Shelf Science, Vol 65, Issue 4, Pages 717-725, ISSN 0272-7714, https://doi.org/10.1016/j.ecss.2005.07.007.
– Kletou D., Kleitou P., Savva I., Attrill M. J., Antoniou C. & Hall-Spencer J. M. (2018) Seagrass recovery after fish farm relocation in the eastern Mediterranean. Marine Environmental Research, doi: 10.1016/j.marenvres.2018.06.007.
– Koopmans D., Holtappels M., Chennu A., Weber M. & De Beer D. (2020) High net primary production of Mediterranean seagrass (Posidonia oceanica) meadows determined with aquatic eddy covariance, Front. Mar. Sci, Vol 7 : 118, doi : 10.3389/fmars.2020.00118
– Lefebvre L., Compère P. & Gobert S. (2023) The formation of aegagropiles from the Mediterranean seagrass Posidonia oceanica (L.) Delile (1813): plant tissue sources and colonisation by melanised fungal mycelium. Mar Biol 170, 19. https://doi.org/10.1007/s00227-022-04166-0
– Les D., Cleland M. & Waycott M. (1997) Phylogenetic Studies in Alismatidae, II: Evolution of Marine Angiosperms (Seagrasses) and Hydrophily. Systematic Botany, 22(3), 443-463. doi:10.2307/2419820
– Manca E., Cáceres I., Alsina J. M., Stratigaki V., Townend I. & Amos C.L. (2012) Wave energy and wave-induced flow reduction by full-scale model Posidonia oceanica seagrass, Continental Shelf Research, Volumes 50–51, Pages 100-116, ISSN 0278-4343, https://doi.org/10.1016/j.csr.2012.10.008.
– Marbà N. & Duarte C.M. (2010) Mediterranean warming triggers seagrass (Posidonia oceanica) shoot mortality. Glob. Chang. Biol. 16, 2366–2375. https://doi.org/10.1111/j.1365-2486.2009.02130.x
– Marbà N., Díaz-Almela E. & Duarte C. M. (2014) Mediterranean seagrass (Posidonia oceanica) loss between 1842 and 2009. Biol. Conserv. 176, 183–190. https://doi.org/10.1016/j.biocon.2014.05.024
– Martin A., Bernard G., Ize S. & Herlory O. (2018) Analyse économique de la gestion des plages : cas des banquettes de Posidonie sur les communes du littoral méditerranéen français. In: Paralia CFL (ed) XVèmes Journées Nationales Génie Côtier – Génie Civil. La Rochelle, France, p 683–692. doi: 10.5150/jngcgc.2018.079.
– Martin C.S., Giannoulaki M., De Leo F., Scardi M., Salomidi M., Knitweiss L., Pace M.L., Garofalo G., Gristina M., Ballesteros E., Bavestrello G., Belluscio A., Cebrian E., Gerakaris V., Pergent G., Pergent-Martini C., Schembri P.J., Terribile K., Rizzo L., Ben Souissi J., Bonacorsi M., Guarnieri G., Krzelj M., Macic V., Punzo E., Valavanis V. & Fraschetti S. (2014) Coralligenous and maërl habitats: Predictive modelling to identify their spatial distributions across the mediterranean sea. Sci. Rep. 4. https://doi.org/10.1038/srep05073
– Massa F., Onofri L. & Fezzardi D. (2017) Aquaculture in the Mediterranean and the Black Sea: a Blue Growth perspective. Paulo A.L.D., Lisa Emelia, S., Anil, M., (Eds.), Handbook on the economics and management of sustainable oceans. Edward Elgar- UnEnvironment. pp. 93-123.
– Mateo M. Á., Sánchez-Lizaso J. L. & Romero J. (2003) Posidonia oceanica ‘banquettes’: a preliminary assessment of the relevance for meadow carbon and nutrients budget, Estuarine, Coastal and Shelf Science, Volume 56, Issue 1, Pages 85-90, ISSN 0272-7714, https://doi.org/10.1016/S0272-7714(02)00123-3.
– Mateo M. Á., Cebrián J., Dunton K. & Mutchler T. (2006) Carbon flux in seagrass ecosystems. In: A.W.D. Larkum, R.J. Orth & C.M. Duarte (Eds), “Seagrass: Biology, Ecology and Conservation”, Springer Publ., New York: 157-191.
– Meinesz A., Cirik Ş., Akcali B., Javel F., Migliaccio M., Thibaut T., Yüksek A. & Procaccini G. (2009) Posidonia oceanica in the Marmara Sea, Aquatic Botany, Vol 90, Issue 1, Pages 18-22, ISSN 0304-3770, https://doi.org/10.1016/j.aquabot.2008.04.013.
– Milazzo M., Badalamenti F., Ceccherelli G. & Chemello R. (2004) Boat anchoring on Posidonia oceanica beds in a marine protected area (Italy, western Mediterranean): Effect of anchor types in different anchoring stages. J. Exp. Mar. Bio. Ecol. 299, 51–62. https://doi.org/10.1016/j.jembe.2003.09.003
– Mohr W., Lehnen N., Ahmerkamp S. et al. (2021) Terrestrial-type nitrogen-fixing symbiosis between seagrass and a marine bacterium. Nature 600, 105–109. https://doi.org/10.1038/s41586-021-04063-4
– Molenaar H. & Meinesz A. (1995) Vegetative Reproduction in Posidonia oceanica: Survival and Development of Transplanted Cuttings According to Different Spacings, Arrangements and Substrates. Botanica Marina, 38, 313-322
– Molenaar H., Meinesz A. & Thibaut T. (2009) Alterations of the Structure of Posidonia Oceanica Beds Due to the Introduced Alga Caulerpa Taxifolia. Scimar 2009, 73, 329-335.
– Montefalcone M., Albertelli G., Morri C., Parravicini V. & Bianchi C. N. (2009) Legal protection is not enough: Posidonia oceanica meadows in marine protected areas are not healthier than those in unprotected areas of the northwest Mediterranean Sea, Marine Pollution Bulletin, Volume 58, Issue 4, Pages 515-519, ISSN 0025-326X, https://doi.org/10.1016/j.marpolbul.2008.12.001.
– Occhipinti-Ambrogi A. (2007) Global change and marine communities: Alien species and climate change. Mar. Pollut. Bull. 55, 342–352. https://doi.org/10.1016/j.marpolbul.2006.11.014
– Pasqualini V., Clabaut P., Pergent G., Benyoussef L. & Pergent-Martini C. (2000) Contribution of side scan sonar to the management of Mediterranean littoral ecosystems. Int. J. Remote Sens. 21, 367–378.
– Pérez M., García T., Invers O. & Ruiz J.M. (2008) Physiological responses of the seagrass Posidonia oceanica as indicators of fish farm impact. Mar. Pollut. Bull. 56, 869–879. https://doi.org/10.1016/j.marpolbul.2008.02.001
– Pergent G., Bazairi H., Bianchi C. N., Boudouresque C. F., Buia M. C., Clabaut P., Harmelin-Vivien M., Mateo M. A., Montefalcone M., Morri C., Orfanidis S., Pergent-Martini C., Semroud R., Serrano O. & Verlaque M. (2012) Les herbiers de Magnoliophytes marines de Méditerranée : résilience et contribution à l’atténuation des changements climatiques. Gland, Suisse et Malaga, Espagne : IUCN. 80 pages.
– Pergent G., Bazairi H., Bianchi C.N., Boudouresque C., Buia M. & Calvo S. (2014) Climate change and Mediterranean seagrass meadows : a synopsis for environmental managers. Mediterr. Mar. Sci. Index. 462–473.
– Pergent-Martini C (1994) Impact d’un rejet d’eaux usées urbaines sur l’herbier à Posidonia oceanica, avant et après la mise en service d’une station d’épuration. PhD dissertation, University of Corsica.
– Pergent-Martini C., Leoni V., Pasqualini V., Ardizzone G. D., Balestri E., Bedini R., Belluscio A., Belsher T., J. Borg J., Boudouresque C. F., Boumaza S., Bouquegneau J. M., Buia M.C., Calvo S., Cebrian J., Charbonnel E., Cinelli F., Cossu A., Di Maida G., Dural B., Francour P., Gobert S., Lepoint G., Meinesz A., Molenaar H., Mansour H. M., Panayotidis P., Peirano A., Pergent G., Piazzi L., Pirrotta M., Relini G., Romero J., Sánchez-Lizaso J. L., Semroud R., Shembri P., Shili A., Tomasello A. & Velimirov B. (2005) Descriptors of Posidonia oceanica meadows: Use and application, Ecological Indicators, Volume 5, Issue 3, Pages 213-230, ISSN 1470-160X, https://doi.org/10.1016/j.ecolind.2005.02.004.
– Piazzi L., Acunto S., Frau F., Atzori F., Cinti M. F., Leone L. & Ceccherelli G. (2021) Environmental Engineering Techniques to Restore Degraded Posidonia oceanica Meadows. Water, 13, 661. https://doi.org/10.3390/w13050661
– Pirrotta M., Tomasello A., Scannavino A., Di Maida G., Luzzu F., Bellissimo G., Bellavia C., Costantini C., Orestano C., Sclafani G. & Calvo S (2015) Transplantation assesment of degraded Posidonia oceanica habitats : site selection and long-term monitoring. Medit. Mar. Sci., 16 (3) : 591-604.
– Randone M., Carlo G. & Di Costantini M., … T.T.-W.M.M., 2017, U., 2017. Reviving the Economy of the Mediterranean Sea: Actions for a Sustainable Future Rome: WWF.
– Ruiz J. M., Pérez M. & Romero J. (2001) Effects of fish farm loadings on seagrass (Posidonia oceanica) distribution, growth and photosynthesis. Marine Pollution Bulletin 42 (9), 749-760. http://dx.doi.org/10.1016/S0025-326X(00)00215-0
– Sánchez-Lizaso J. L., Fernandez Torquemada Y. & González-Correa J. M. (2009) Evaluation of the viability of Posidonia oceanica transplants associated with a marina expansion. Bot. Mar., 52, 471–476.
– Telesca L., Belluscio A., Criscoli A., Ardizzone G., Apostolaki E.T., Fraschetti S., Gristina M., Knittweis L., Martin C.S., Pergent G., Alagna A., Badalamenti F., Garofalo G., Gerakaris V., Louise Pace M., Pergent-Martini C. & Salomidi M. (2015) Seagrass meadows (Posidonia oceanica) distribution and trajectories of change [WWW Document]. Sci. Rep. https://doi.org/10.1038/srep12505
– Tomasello A., Di Maida G., Calvo S., Pirrotta M., Borra M. & Procaccini G. (2009) Seagrass meadows at the extreme of environmental tolerance: the case of Posidonia oceanica in a semi‐enclosed coastal lagoon. Marine Ecology, 30: 288 300. https://doi.org/10.1111/j.1439-0485.2009.00285.x
– Tomasello A., Pirrotta M.,& Calvo S. (2019) Construction underwater landscape by using Posidonia oceanica transplanting combined with innovative artificial reefs. In Proceedings of the 6th Mediterranean Symposium on Marine Vegetation, Antalya, Turkey, 14–18 January 2019; pp. 92–96.
– Vangeluwe D., Lepoint G., Bouquegneau J. M. & Gobert S. (2004) Effets de la transplantation sur les pousses de Posidonia oceanica. Vie et Milieu, 54 (4) : 223-230.
– Vassallo P., Paoli C., Rovere A., Montefalcone M., Morri C. & Bianchi C. N. (2013) The value of the seagrass Posidonia oceanica: A natural capital assessment, Marine Pollution Bulletin, Vol 75, Issues 1–2, Pages 157-167, ISSN 0025-326X, https://doi.org/10.1016/j.marpolbul.2013.07.044.
– Vázquez-Luis M., Álvarez E., Barrajón A., García-March J. R., Grau A., Hendriks I. E., Jiménez S., Kersting D., Moreno D., Pérez M., Ruiz J. M., Sánchez J., Villalba A. & Deudero S. (2017) S.O.S. Pinna nobilis: A Mass Mortality Event in Western Mediterranean Sea. Front. Mar. Sci. 4:220. doi: 10.3389/fmars.2017.00220
– Vohník M., Borovec O., Kolaříková Z., Sudová R. & Réblová M. (2019) Extensive sampling and high-throughput sequencing reveal Posidoniomyces atricolor gen. et sp. nov. (Aigialaceae, Pleosporales) as the dominant root mycobiont of the dominant Mediterranean seagrass Posidonia oceanica. MycoKeys 55: 59–86. doi: 10.3897/mycokeys.55.35682.
– Ward E. A., Meek S. K., Gordon D. M., Cameron T. C., Steer M. D., Smith D. J., Miliou A. & Tsimpidis T. (2020) The use of storm fragments and biodegradable replanting methods allows for a low-impact habitat restoration method of seagrass meadows, in the eastern Aegean Sea. Conservation Evidence, 17, 1-6.
– Williams S. L. (2001) Reduced genetic diversity in Z. marina transplantations affects both population growth and individual fitness. Ecol. Appl. 11 : 1472 – 1488
– Zunino S., Canu D. M., Marangon F. & Troiano S. (2020) Cultural ecosystem services provided by coralligenous assemblages and Posidonia oceanica in the Italian seas, Front. Mar. Sci. 6, 823. https://doi.org/10.3389/fmars.2019.00823
Ouvrage
Alexandre Meinesz & al. (2016) Méditerranée Mer Vivante, 19e édition, ed. Lions Clubs, 12-15p.
Sites Internet
– Boisleux Géraldine, Pean Michel, Harmelin Jean-Georges in : DORIS, 15/01/2021 : Posidonia oceanica (L.) Delile, https://doris.ffessm.fr/ref/specie/265
– Dossier Futura-Science écrit par le Pr. Charles-François Boudouresque : https://www.futura-sciences.com/planete/dossiers/nature-posidonie-miracle-mediterranee-2006/