Description du projet
Dans la mer Méditerranée, il y a de longues étendues de côtes rocheuses caractérisées par la présence de nombreuses, et souvent inexplorées, grottes sous-marines. Ces environnements, extrêmes et uniques, sont parmi les rares habitats marins sous protection par la Communauté Européenne (Directive Habitat 92/43EEC). A l’intérieur, vit le roi des rougets, le poisson cardinal, Apogon imberbis, ayant un rôle possiblement crucial pour tout l’écosystème !
Texte par Jean-Vincent Vieux-Ingrassia – NaturDive
Qu’est-ce que l’écosystème des grottes sous-marine ?
Cet écosystème, très particulier, abrite une formidable biodiversité, unique et fragile. En raison des conditions environnementales spécifiques comme l’extinction progressive de la lumière, la turbidité, les courants et la distribution des ressources trophiques, il est seulement comparable aux écosystèmes profonds (Harmelin et al., 1985 ; Bianchi et al., 1996 ; Bussotti et al., 2006 ; Giakoumi et al., 2013 ; Rastorgueff et al., 2015 ; Gerovasileiou et al., 2017 ; Scotti et al., 2017).
À l’intérieur des grottes, de nombreuses espèces fixées, telles que les algues rouges, les anthozoaires encroûtants, les bryozoaires, les éponges et les polychètes ont été recensées. La répartition de ces espèces dans l’espace est hétérogène dans une grotte donnée. Et lorsque l’on étudie un grand nombre de grotte à travers toute la Méditerranée, on constate que cette répartition biologique est très différente d’une grotte à l’autre. Le gradient de luminosité et l’atténuation des courants seraient des forces importantes expliquant cette variabilité entre milieux cavernicoles (Cinelli et al., 1997 ; Bussotti et al., 2006 ; Rastorgueff et al., 2015 ; Gerovasileiou et al., 2017 ; Scotti et al., 2017).

Les différentes morphologies des grottes. Les petits encadrés, en haut de chaque figure, représentent deux choses : le mouvement de l’eau via les ondulations, et la pénétration de la lumière (les parties blanches par rapport aux parties grises) © Gerovasileiou & Bianchi 2021, revu et modifié à partir de Riedl (1966) et Hofrichter (2002)
©Jean-Georges Harmelin
De gauche à droite, et de haut en bas, : l’éponge Agelas sp. soufflant de la fluorescéine (un colorant utilisé pour visualiser la circulation d’eau provoquée par les cellules flagellées de l’éponge), la crevette cavernicole jaune (Stenopus spinosus) ; l’anémone encroûtante jaune (Paraxoanthus axinellae), l’éponge encroûtante orange (Spirastrella cunctatrix), un ver annélide polychète (Protularia sp.) et deux essaims de crevettes mysidacées : respectivement Siriella clausii et Leptomysis sp.
La principale limite biologique de cet écosystème est l’absence de producteurs primaires permettant de soutenir le milieu (Harmelin et al., 1985 ; Bianchi et al., 1996 ; Bussotti et al., 2006 ; Rastorgueff et al., 2011, 2015 ; Bussotti et al., 2018). En effet, un réseau trophique a besoin d’une entrée de matière et d’énergie, généralement assurée par les organismes chlorophylliens, dits producteurs primaires. Ceux-ci sont consommés par des consommateurs primaires (herbivores), puis vient le tour des consommateurs secondaires (prédateurs), jusqu’aux espèces apicales, sommet de la chaîne alimentaire. Les déjections et cadavres sont dégradés par les détritivores et nécrophages afin de réalimenter le réseau. Dans cet écosystème, ce réseau est un peu différent !
En l’absence de végétaux, dû à l’absence de lumière, ce rôle de production primaire est donc nécessairement assuré par d’autres catégories d’êtres vivants, comme de petites crevettes, appelées Mysidacés (Ledoyer, 1989 ; Rastorgueff et al., 2011), qui par leur nombre très important et leur déplacement, assurent un transfert de matière organique de l’extérieur de la grotte vers l’intérieur.
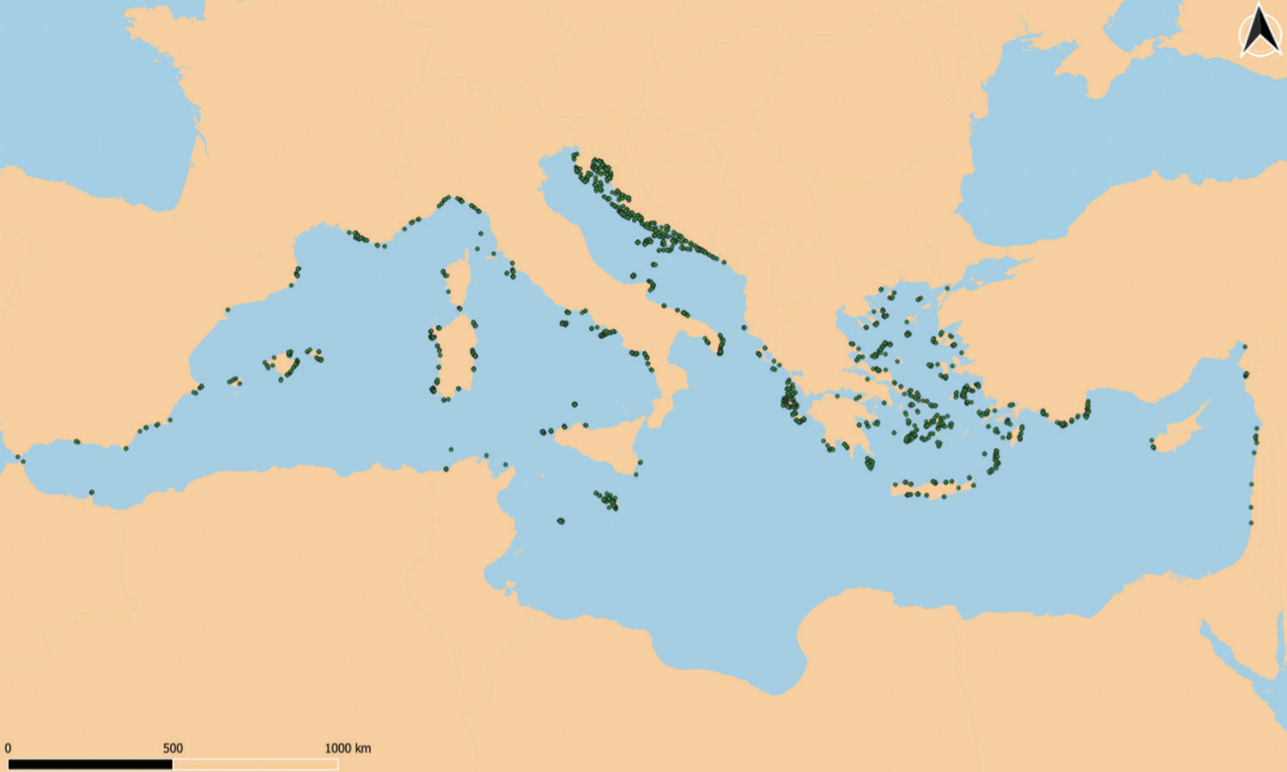
Distribution des grottes marines connues (points verts) en Mer Méditerranée © Gerovasileiou & Bianchi 2021, sur la base des données de Giakoumi et al. (2013), Sini et al. (2017) et LIFE BaĦAR pour le projet N2K – LIFE12 NAT/MT/000845

Essaim de Mysidacés (Hemimysis sp.) © Jean-Georges Harmelin
Qu’en est-il chez les poissons ?
Les poissons y sont aussi très fréquents. On y retrouve des espèces de passage comme les sars (ex : Diplodus vulgaris, Diplodus annularis) ou les oblades (Oblada melanura), des espèces cryptiques, spécifiques à ce milieu, comme l’apogon (Apogon imberbis) ou le faufré noir (Grammonus ater) et des espèces benthiques, c’est-à-dire associées aux fonds marins comme des gobies (ex : Corcyrogobius liechtensteini, Thorogobius ephipiatus) et des triptérygions (ex : Tripterygion melanurum) (Garnaud, 1962 ; Muths et al., 2015 ; Bussotti et al., 2015, 2017). A la vue de sa fréquence et de sa distribution, l’hypothèse d’un rôle crucial dans le transfert de matière organique se porte sur l’Apogon (Webster et al., 2010).

Le gobie léopard (Thorogobius ephipiatus) ©Jean-Georges Harmelin

Le faufré noir (Grammonus ater) ©Jean-Georges Harmelin

Un banc d’apogons (Apogon imberbis) ©Jean-Georges Harmelin

Le triptérygion nain (Tripterygion melanurum) ©Jean-Georges Harmelin
Quelques mots sur l’apogon, le poisson cardinal…
Apogon imberbis (L.) 1758 est un petit poisson rouge, de 15 cm maximum, très fréquent dans les grottes. Il est le seul membre de la famille des Apogonidae à être indigène de la mer Méditerranée. « Apogon » signifie ‘sans barbe’ en grec, tout comme « imberbis ». Mais pourquoi ? Car sa couleur fait penser à un rouget classique, mais sans les barbillons, donc imberbe. Il possède 2 nageoires dorsales distinctes, 2 nageoires ventrales courtes, 2 pectorales et une caudale arrondie. Toutes sont transparentes.
Ce prédateur est caractérisé par une couleur uniforme rouge, voire orangée, laquelle est associée à de gros yeux globuleux noirs, striés de deux bandes blanches horizontales. Sa tête est terminée par une bouche protractile, c’est-à-dire capable d’être projetée, étendue, vers l’avant.

Un individu entier © Samuel Jeglot
De nombreux plongeurs ont pu l’observer se cachant la journée dans l’obscurité des failles, trous et anfractuosités des roches. Même s’il apprécie ces milieux cavernicoles, il peut se tenir devant les cavités, même de jour. La nuit, par contre, les bancs sortent et s’alimentent tellement, que la nourriture finit par dépasser de la bouche. C’est donc une espèce sciaphile, un prédateur nocturne et un glouton !
Ce carnassier se nourrit principalement de mysidacés et d’amphipodes, mais aussi d’annélides, de copépodes, de décapodes, de larves et parfois même de petits poissons (Garnaud, 1962 ; Bussotti et al., 2018).
Ci-dessous des photos de proies retrouvées dans des estomacs d’apogon.

Un individu au milieu de coraux rouges © Samuel Jeglot

Galathée © Jean-Vincent Vieux-Ingrassia

Décapode © Jean-Vincent Vieux-Ingrassia

Gastéropode © Jean-Vincent Vieux-Ingrassia

Nématode © Jean-Vincent Vieux-Ingrassia

Amphipode © Jean-Vincent Vieux-Ingrassia

Crevette © Jean-Vincent Vieux-Ingrassia

Régime alimentaire d’Apogon imberbis © Jean-Vincent Vieux-Ingrassia
Son espérance de vie, pour les deux sexes, est de 5 ans, ce qui est la plus longue parmi les Apogonidae, et la maturité sexuelle est atteinte à partir d’une taille de 5,5 cm, correspondant à 1 an de vie (Raventos, 2007).
La parade nuptiale commence en juin, dans une eau plutôt chaude. Le mâle décrit des cercles horizontaux autour de la femelle et resserre la ronde nuptiale jusqu’à la toucher presque. Cette dernière tourne en même temps et finit par représenter elle-même l’axe de rotation. Cela suffit à évacuer les œufs mûrs, que le mâle retient un instant dans sa nageoire anale placée en gouttière vers l’intérieur, afin d’en assurer la fécondation (Garnaud, 1950). Ce manège reprendra jusqu’à épuisement du stock d’œufs.

Un mâle avec une ponte dans la bouche © Stéphane Jamme
Après une période de reproduction de Juin à Octobre, le mâle incubera les quelques 20 000 œufs très petits, qui sont amalgamés en une boule, et les conserve jusqu’à éclosion dans sa cavité buccale qui s’agrandit considérablement, ainsi que dans sa gorge (Garnaud, 1950 ; Luther & Fiedler, 1987 ; Raventos, 2007). L’amas d’œufs reste mobile et le mâle le retourne de temps à autre pour assurer une oxygénation constante (Luther & Fiedler, 1987). Chaque mouvement de déglutition laisse parfois déborder quelques fragments qui sont aussitôt ravalés. Le mâle respire ensuite très largement, à un rythme profond et ralenti pour aérer les œufs (Garnaud, 1950).
Malgré un comportement grégaire, il est capable d’être également solitaire. Cette plasticité de comportement lui permet de bénéficier d’un large éventail d’abris ombragés favorisant la connectivité des populations (Rastorgueff, 2020). La solitude est plus prononcée pendant la phase de couvaison afin d’éviter de possibles conflits et s’épargner une perte d’énergie, notamment en raison du jeun obligatoire durant l’incubation buccale des œufs.

On remarque l’agrandissement de la cavité buccale © Stéphane Jamme
Rôle trophique majeur
Tout d’abord, cette espèce est présente dans la grande majorité des grottes sous-marines de Méditerranée.
Des études génétiques, sur des populations d’apogons vivants dans différentes grottes dans une même région, ont montré une homogénéité du patrimoine génétique (Webster et al., 2010 ; Muths et al., 2015 ; Bussotti et al., 2017 ; Rastorgueff, 2020). Il existerait donc des flux d’individus entre les grottes qui empêchent un potentiel phénomène de spéciation sur une plus large échelle.
Des individus se déplaceraient donc de grottes en grottes et les larves se dissémineraient, par les courants, vers les milieux les plus éloignés, selon un modèle de « stepping-stones » (Poortvliet et al., 2013 ; Bussotti et al., 2017). Cette hypothèse est encore en cours d’études, car contraire au comportement des autres Apogonidae.
De nombreuses études ont pu déterminer qu’Apogon imberbis présente une biomasse et une densité telles (~ 10 000 individus/ hectare) qu’il est très probable qu’il joue un rôle crucial dans le maintien de l’écosystème des grottes sous-marines de Méditerranée (Bussotti et al., 2003, 2015, 2017, 2018 ; Webster et al., 2010).
Bussotti et al., 2018 ont pu démontrer que cette espèce réalise une migration nycthémérale (i.e. jour/nuit) pour chasser. Cette chasse se pratique aux abords des grottes, mais pas seulement. Les apogons sont capables de se nourrir dans les phytocénoses, communautés végétales d’algues et/ou de plantes marines. Le contenu stomacal ayant démontré la présence d’espèces typiques de ces milieux végétaux comme les amphipodes Dexamine spinosa, Aphera spp., le décapode Galathea bolivari et les vers polychètes Lysidice ninetta et Lysidice unicornis (Bussotti et al., 2018). Cette zone de chasse s’étend également dans la colonne d’eau avec la présence, dans les estomacs, d’un euphausiacé typique des remontées d’eau profondes : Maganyctiphanes norvegica, le krill norvégien (Bussotti et al., 2018). Ça serait donc lors de son retour, à l’aube, qu’il pourrait contribuer à un transfert horizontal de matières organiques, par ses déjections.
Ses fèces permettraient d’augmenter la charge en matières organiques des grottes soutenant, directement ou indirectement, la biomasse des bactéries décomposeuses et donc d’alimenter le réseau trophique de l’écosystème. Les mysidacés et l’apogon contribueraient donc à une diversification de la qualité de matière organique disponible dans l’écosystème des grottes (Bussotti et al., 2017, 2018).
Il reste encore à quantifier les déjections émises afin de prouver cette hypothèse.

Banc d’apogons (Apogon imberbis) © Bussotti et al. 2018

Comportement nycthéméral de l’apogon (en haut : l’activité diurne / en bas : activité nocturne) © Bussotti et al. 2018
Un remerciement particulier à Jean-Georges Harmelin et à Stéphane Jamme pour leurs contributions photographiques
BIBLIOGRAPHIE
Bianchi CN., Cattaneo-Viett R., Cinelli F., Morri C., & Pansini M. (1996) Lo studio biologico delle grotte sottomarine del Mediterraneo: Conoscenze attuali e prospettive. Boll. Mus. Ist. Biol. Univ. Genova 60–61: 41–69.
Bussotti S., Guidetti P., & Belmonte G. (2003) Distribution patterns of the cardinal fish, Apogon imberbis, in shallow marine caves in southern Apulia (SE Italy). Italian Journal of Zoology 70:2, 153-157, doi: 10.1080/11250000309356509.
Bussotti S., Terlizzi A., Fraschetti S., Belmonte G., & Boero F. (2006) Spatial and temporal variability of sessile benthos in shallow Mediterranean marine caves. Mar Ecol Prog Ser 325: 109–119.
Bussotti S., Di Franco A., Francour P., & Guidetti P. (2015) Fish Assemblages of Mediterranean Marine Caves. PLoS ONE 10(4): e0122632.
Bussotti S., Di Franco A., Pey A., Vieux-Ingrassia JV., Planes S., & Guidetti P. (2017) Distribution patterns of marine cave fishes and the potential role of the cardinal fish Apogon imberbis (Linnaeus, 1758) for cave ecosystem functioning in the western Mediterranean. Aquat. Living Resour. 30: 15.
Bussotti S., Di Franco A., Bianchi C.N., Chevaldonné P., Egea L., Fanelli E., Lejeusne C., Musco L., Navarro-Barranco C., Pey A., Planes S., Vieux-Ingrassia JV., & Guidetti P. (2018) Fish mitigate trophic depletion in marine cave ecosystems. Sci Rep 8, 9193. https://doi.org/10.1038/s41598-018-27491-1.
Cinelli F., Fresi E., Mazzella L., Pronzato M., Pansini M., & Svoboda A. (1977) Distribution of benthic phyto- and zoocoenoses along a light gradient in a superficial marine cave. In: Keegan BF, O’Céidigh P, Boaden PJS, eds. Biology of benthic organisms. Oxford: Pergamon Press, pp. 173–183.
Garnaud J. (1950). Notes partielles sur la reproduction d’Apogon imberbis. Rev Ecol Terre Vie 1: 39-42.
Garnaud J. (1962) Monographie de l’Apogon méditerranéen: Apogon imberbis (L.) 1758. Bull. Inst. Océanogr. (Monaco) 1248, 1–83.
Gerovasileiou V., Dimitriadis C., Arvanitidis C., Voultsiadou E. (2017) Taxonomic and functional surrogates of sessile benthic diversity in Mediterranean marine caves. PLoS ONE 12(9): e0183707. https://doi.org/10.1371/journal.pone.0183707
Gerovasileiou V. & Bianchi C. N. (2021) Mediterranean marine caves : a synthesis of current knowledge. Oceanography and Marine Biology, Vol. 59 : 1-88.
Giakoumi S., Sini M., Gerovasileiou V., Mazor T., Beher J., Possingham HP., et al. (2013) Ecoregion-based conservation planning in the Mediterranean: dealing with largescale heterogeneity. PloS ONE 8(10): e76449. https://doi.org/10.1371/journal.pone.0076449.
Harmelin JG., Vacelet J., & Vasseur P. (1985) Les grottes sous-marines obscures: un milieu extrême et un remarquable biotope refuge. Téthys 11: 214–229.
Ledoyer M. (1989) Les mysidacés (Crustacea) des grottes sous-marines obscures de Méditerranée Nord-occidentale et proche atlantique. Mar Nat 2: 39–62.
Luther W. & Fiedler K. (1987) Guide de la faune sous-marine des côtes méditerranéennes. Les Guides du Naturaliste.
Muths D., Rastorgueff PA., Selva M., & Chevaldonné P. (2015). Local scale connectivity in the cave-dwelling brooding fish. Journal of Sea Research, 95, 70–74.
Poortvliet M., Longo GC., Selkoe K., et al. (2013) Phylogeography of the California sheephead, Semicossyphus pulcher: the role of deep reefs as stepping stones and pathways to antitropicality. Ecol Evol 3: 4558–4571.
Rastorgueff PA., Harmelin-Vivien M., Richard P., & Chevaldonné P. (2011) Feeding strategies and resource partitioning mitigate the effects of oligotrophy for marine cave mysids. Mar Ecol Prog Ser 440: 163–176.
Rastorgueff PA., Bellan-Santini D., Bianchi C.N, Bussotti S., Chevaldonné P., Guidetti P., Harmelin JG., Montefalcone M., Morri C., Perez T., Ruitton S., Vacelet J. & Personnic S. (2015) An ecosystem-based approach to evaluate the ecological quality of Mediterranean undersea caves. Ecological Indicators, Vol 54, 137-152.
Rastorgueff PA. (2020) Social flexibility to balance habitat fragmentation? Insights from the Mediterranean cave-dwelling cardinalfish Apogon imberbis. Mar Ecol, 41:e12581 https://doi.org/10.1111/ maec.12581.
Raventos N. (2007) Age, growth and reproductive parameters of the Mediterranean cardinal fish, Apogon imberbis . Journal of Applied Ichthyology, 23: 675-678. doi:10.1111/j.1439-0426.2007.00847.x.
Scotti G., Consoli P., Esposito V., Chemello R., Romeo T., et al. (2017) Marine caves of the Southern Tyrrhenian Sea: a First Census of Benthic Biodiversity. J Marine Sci Res Dev 7: 238. doi:10.4172/2155-9910.1000238.
Webster P., Swann K., & Richtik-Rinaudo M. (2010) Diel distribution and site fidelity of Apogon imberbis in shallow rocky reefs in Corsica, France. BIOE159 Marine Ecology of Corsica Field.