Description du projet
Les poulpes sont de fascinantes créatures, capable de changer de couleur, de résoudre des problèmes, de cracher de l’encre et de se déformer. Cet article vous permettra d’en savoir plus sur eux.
Texte : Jean-Vincent Vieux-Ingrassia / NaturDive
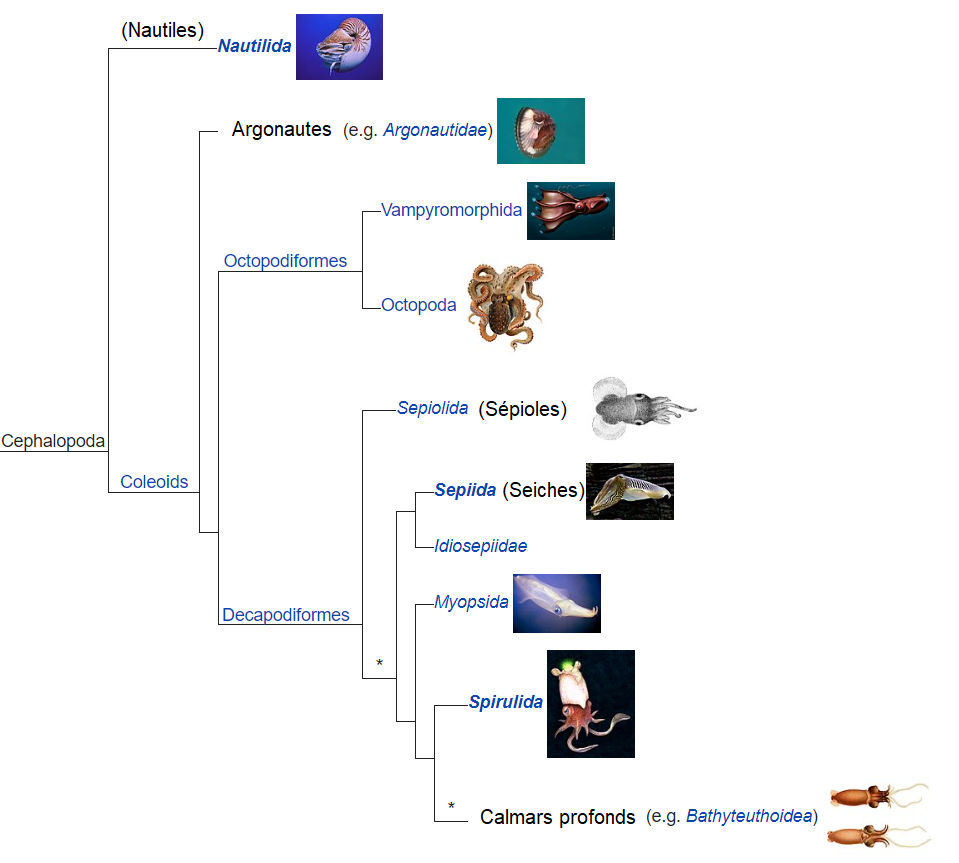
La Classification des Poulpes
Les poulpes font partie de la Classe des Céphalopodes, ce qui signifie littéralement « tête »et « pied ». Cette dénomination est inexacte, puisque ces mollusques n’ont pas de pied, mais des mains, il faudrait donc les nommer céphalochires. Une autre interprétation du nom serait le fait d’avoir un cerveau dans les pieds. Ce qui est une réalité ! Le poulpe possède en effet un cerveau principal, dit central, et huit cerveaux dits périphériques, chacun dans un bras. Cette structure neuronale permet de développer les sens du toucher, d’odorat et du goût via les bras, ainsi que d’autres capacités cognitives complexes (Boyle & Rodhouse 2005).
Puis, elles font partie de l’Ordre des Octopoda, car elles possèdent huit bras. Partant de ce point, nous pouvons diviser cet Ordre en deux parties : les Cirrina qui regroupent les espèces des profondeurs et évoluant en pleine eau dites poulpes pélagiques abyssales, et les Incirrina qui regroupent les espèces vivant sur le fond et dans les zones lumineuses, dites poulpes benthiques épipélagiques (Boyle & Rodhouse 2005). On notera donc que les « calmars » et les « seiches » ne sont pas des octopodes, mais des décapodiformes puisque ayant dix tentacules !
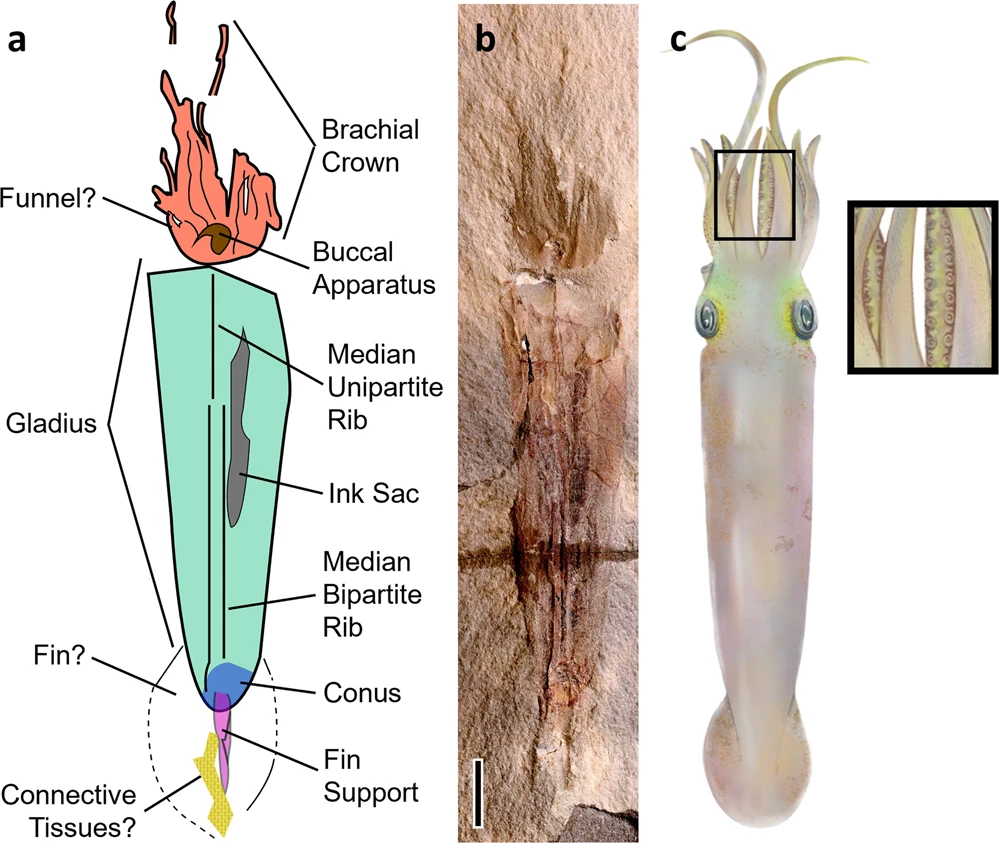
Dans la systématique actuelle, il existe un Ordre, cousin des Octopodes : les Vampyromorphida. Le vampire des abysses (Vampyroteuthis infernalis) en est le seul représentant encore en existence. Il se trouve que les vampires et les poulpes partagent un même ancêtre commun. Celui-ci mesurait 12cm, avait 10 bras, dont 2 plus longs, une poche à encre, et daterait de presque 330 millions d’années (Whalen & Landman 2022). Cela signifie que l’état ancestral des poulpes était un organisme à 10 bras, comme les calmars, 2 bras ayant été donc perdus au cours de l’évolution.
De nombreux scientifiques remettent en question la systématique actuelle des céphalopodes depuis plusieurs dizaines d’années, et suggèrent de refaire en totalité la classification en raison de découvertes en matière de génétique et d’analyses moléculaires (Von Boletzky 1999 ; Strugnell & Nishiguchi 2007), mais ici nous resterons simple.
Ci-contre : A) Dessin schématique de Syllipsimopodi bideni (ancêtre commun aux poulpes et vampires actuels) ; vert = gladius (partie dure du corps interne), orange = tête (y compris les bras), brun = appareil buccal, gris = sac d’encre, bleu = cône, magenta = support des nageoires, motifs jaunes = taches ressemblant à des écailles (possible vestige de tissu conjonctif). B) Image en fausses couleurs à contraste accru de Syllipsimopodi, holotype ROMIP 64897. Échelle = 1 cm. C) Reconstitution artistique montrant des ventouses (créée par K. Whalen).
Commençons par les plus connus, les poulpes communément observés, ceux des côtes littorales, notamment le poulpe commun.
Brisons le mythe selon lequel il y aurait la femelle pieuvre et le mâle poulpe. Pieuvre et Poulpe ne sont qu’un seul et même animal ! « Poulpe » signifie « plusieurs pieds » en grec, et est ancien, tandis que « Pieuvre » est un mot plutôt très récent, d’origine guernesiaise, et qui a été popularisée par Victor Hugo dans son ouvrage « les Travailleurs de la mer ».
I/ Les octopodes littoraux : exemple du poulpe commun
Généralités
Octopus vulgaris est le poulpe commun, c’est la plus étudiée des espèces de poulpe en raison de sa répartition mondiale. Ses habitats de prédilection sont les rochers et parfois les fonds sableux jusqu’à 100 m de profondeur, il est également capable de nager en pleine eau quelques instants, on qualifie cette espèce de benthique, c’est-à-dire nageant sur les fonds marins (Certain et al. 2021).
Le poulpe commun peut atteindre 1m de long et peser 8 kilos en consommant des crustacés comme des crabes marbrés, des mollusques comme les ormeaux, dont il est très friand, et d’autres invertébrés (Certain et al. 2021). Durant sa chasse, il se déplace peu, quelques centaines de mètres tout au plus (Mereu et al. 2015). C’est pendant les migrations saisonnières qu’il se déplacera beaucoup, notamment pour la reproduction. Le reste du temps, il reste dans son abri, caché derrière des rochers et des coquilles vides de mollusques. Pour échapper à ses prédateurs, comme la murène ou le mérou, il utilise de l’encre provenant de sa ‘Poche du noir’. Cet organe lui permet d’expulser des jets d’encres par un orifice situé proche de l’anus. Ce panache peut persister jusqu’à 10 minutes dans l’eau, avant de se disperser complètement.
Ses capacités de fécondité sont importantes car il peut pondre entre 70 000 et 634 000 œufs en 15 à 30 jours, une courte durée de vie de 1 à 2 ans et une croissance rapide (Sobrino et al. 2020). A noter qu’après la reproduction, les individus meurent, on dit que cette espèce est sémelpare, elle ne se reproduit qu’une fois dans sa vie avant de mourir. La femelle reste proche de ses œufs, les ventilant, les défendant, jusqu’à en mourir, de faim la plupart du temps !
Même si l’on a constaté des pics de reproduction en été dans les régions tempérées, c’est différent selon les zones. En effet, au Maroc, ce sera plutôt au printemps et en automne (Faraj & Bez 2007), tandis qu’au Portugal, ce sera au printemps et en été (Robin et al. 2014). Les conditions environnementales locales ont donc une importance considérable sur la reproduction de cette espèce, notamment la température. La durabilité des stocks dépend de la connaissance des périodes de reproduction selon les zones exploitées.
Des études ont pointé la baisse des stocks des céphalopodes dans le monde, mais de grandes précautions doivent être prises avec ces données, car il y a de très fortes variations de populations d’année en année dues au taux très variables de mortalité des larves résultant de variations importantes des paramètres environnementaux (Pierce et al. 2010). En ce qui concerne le poulpe commun, son abondance est due au succès de recrutement des juvéniles (Robin et al. 2014 ; Sobrino et al. 2020). C’est-à-dire au succès de la survie des nouveaux arrivants et de leur nombre.
En Méditerranée, il est interdit de pêcher le poulpe commun dans le Parc National des Calanques (13) entre le 1er juin et le 30 septembre, pour le protéger pendant sa période de reproduction. Le poulpe commun est inscrit depuis 2018 dans la Liste rouge mondiale de l’UICN au statut LC (Least Concern, soit une préoccupation mineure).
De la larve à l’adulte
La survie des larves et des juvéniles est cruciale pour la survie d’Octopus vulgaris. Nous allons alors nous pencher sur son développement.
Après éclosion, la survie des larves dépend, en grande partie, du passage critique d’une alimentation endogène, basée sur la réserve du jaune de l’œuf, à une alimentation exogène par capture de proie. Le développement du cerveau démarre alors avec la prise de nourriture dans l’eau. L’acquisition des capacités de nage, de prédation ou de fuite face aux prédateurs ne sont pas identiques selon les individus. En effet, un individu développant ces capacités précocement serait à même de survivre mieux que les autres, et expliquerait la grande variabilité de performances des jeunes larves issues d’une même ponte (Robin et al. 2014).
Durant ce développement, la température, la salinité, l’oxygène dissous et la présence de proies sont d’autant de facteurs qui vont influencer la survie des larves planctoniques (Robin et al. 2014 ; Garrido et al. 2017).
Après cette phase larvaire, les individus deviennent des paralarves, des juvéniles. Une phase qui peut montrer une grande mortalité en raison de la variation de la biodisponibilité du zooplancton. Ils ont en effet grandement besoin de microscopiques crustacés. La présence ou l’absence de ces proies sera crucial.
Le passage entre paralarves et jeunes adultes n’est pas une métamorphose, car ils ont déjà les caractéristiques morphologiques. Néanmoins, il va se passer quelque chose : ils vont grandir rapidement, particulièrement si la température est au-dessus de 23°C (Robin et al. 2014). Cette croissance soudaine va également affecter le comportement et l’écologie du poulpe, qui passe alors d’une vie planctonique en pleine eau, à une vie sur le fond, benthique, proche du littoral. Le régime alimentaire change, comme sa sociabilité et sa prédation. C’est cette installation côtière qui représente le recrutement des jeunes. L’arrivée de ces nouveaux individus est également fortement lié à l’existence de remontées d’eaux côtières les amenant avec les courants (Robin et al. 2014 ; Certain et al. 2021).
Les cerveaux du poulpe
Tout le monde sait dorénavant que les poulpes, comme les seiches et les calmars, sont particulièrement intelligents. Une exception chez les invertébrés qui pousse à se poser des questions. Surtout que la mère meurt après l’éclosion des œufs donc aucun apprentissage vers ses enfants. Comment font-ils pour apprendre ? Peut-être par l’observation de leurs congénères une fois jeunes adultes, peut-être simplement par eux-mêmes.
Néanmoins, il faut se pencher sur sa structure neuronale pour mieux comprendre.
Les bras du poulpe remplissent des rôles moteurs et sensoriels. Afin de réaliser tous ces mouvements libres, ceux-ci ne sont pas emplis d’un squelette rigide, mais d’un ensemble de petites fibres musculaires serrées entre elles. Au niveau neuronal, pas moins de 180 millions de neurones dans le cerveau central sont connectés à plus de 40 millions de neurones dans chacun des huit bras, ce qui fait 500 millions de neurones (Young 1971 ; Zullo et al. 2019). En comparaison, les grenouilles en ont 16 millions de neurones, les mésanges en ont 83 millions, les cochons d’Inde en ont 240 millions et les chats en ont 760 millions. Pour information, l’humain en possède 86 milliards.
Et pour les faire bouger, à peu près 1500 motoneurones, donc des neurones activant les muscles, innervent une section de bras d’1mm de long, dans un bras de 25 cm de long (Levey et al. 2017 ; Zullo et al. 2019). On comprend mieux pourquoi le poulpe a cette capacité de mouvement inégalable. La majorité de l’information sensorielle et des commandes motrices serait due au système nerveux périphérique, donc aux bras eux-mêmes.
Cette intelligence leur a fait développer des sentiments comme l’anxiété, l’ennui ou encore la joie (Birch et al., 2021). Cette capacité est un argument de poids contre la mise en place de fermes d’élevage de poulpe en Espagne. Non seulement ces animaux sont doués d’émotions, mais ils supportent mal la présence d’autres congénères, et finissent par s’ennuyer profondément en captivité, aboutissant à des détresses psychologiques établies.
Le mimétisme
Il est bien connu que certains poulpes ont la capacité de changer délibérément et rapidement la couleur et les irrégularités de leur peau pour imiter l’environnement (Josef et al. 2012), c’est le mimétisme. Celui-ci sert aussi pour se défendre face aux prédateurs et à communiquer entre individus.
Le mécanisme, utilisé par ces céphalopodes, consiste à contrôler la taille des chromatophores épidermiques, des cellules qui réfléchissent la lumière, via des cellules nerveuses. Les chromatophores contiennent des granules de pigment qui régulent les effets de couleur en changeant de taille. En ajustant la taille du chromatophore avec les muscles, il est possible de changer la couleur rapidement. De plus, il existe des chromatophores iridescents, des chromatophores blancs et des cellules réflexes sous la couche de chromatophores qui créent une palette de couleurs diversifiée (Messenger et al. 1997 ; Ishida 2021). Cependant, les mécanismes impliqués dans tout ce processus de mimétisme ne sont pas encore élucidés.
Autres espèces de poulpes littoraux
Il n’y a pas que le poulpe commun qui évolue le long de nos côtes, d’autres espèces, des cousines, peuvent être rencontrées. Découvrons qui elle sont.
Pour commencer, il y a le poulpe à longs bras (Macrotriptopus defilippi). Cette espèce se déplace au niveau des fonds sablo-vaseux. On la connait pour ses aptitudes au mimétisme. En effet, elle est capable non seulement d’imiter la forme des poissons plats, mais également leur déplacement particulier ainsi que leur attitude, une ingénieuse prouesse !
Dans ce même environnement, on peut observer l’Elédone musquée (Eledone moschata). Son nom lui vient de sa capacité à sécréter une odeur de musk. Ce poulpe des sables évolue dans de grandes étendues sablonneuses et est nocturne. Durant la journée, il préfère s’enfouir dans le sédiment. Il utilise alors une technique bien à lui. Avec son corps et son siphon directionnel, il aspire de l’eau dans son manteau, se gonfle et projette ainsi un jet suffisamment puissant pour soulever le sable. Il va répéter l’exercice entre trois et quatre fois, puis il creuse un trou, large et profond, afin de s’y glisser tranquillement. Afin de terminer son travail d’enfouissement, ses huit tentacules vont refermer ce terrier. Ni vu, ni connu !
Il existe également le poulpe tacheté (Callistoctopus macropus). Sa couleur rouge brique à pois blancs phosphorescents est caractéristique de l’espèce. Cette coloration, quoique très voyante, n’est pas un souci car il est exclusivement nocturne. Ce chasseur redoutable sait très bien utiliser la succion de ses ventouses pour parvenir à ses fins. En effet, au delà de chasser, s’il se sent en danger, le poulpe tacheté prend une posture d’intimidation. Il se redresse, hérisse son manteau, intensifie sa couleur rouge et contracte ses tentacules, positionnant ses ventouses face au danger. Ce qui suffit parfois à impressionner !
Dessin représentant la poulpe à longs bras par Guiseppe Jatta dans son livre de 1896 : I Cefalopodi viventi nel Golfo di Napoli (sistematica) : monografia
II / Les octopodes des profondeurs
a) Les Cirrina ou octopodes abyssaux pélagiques
Les Cirrina sont des organismes ressemblant à des poulpes, même s’ils partagent peu de points communs avec leurs homonymes littoraux.
Leurs caractéristiques principales sont :
- La présence d’une paire de cils à côté de chaque ventouse, sous les bras
- Une liaison des bras entre eux par une ombelle
- Leur poche d’encre et leur langue radula ont régressé
- Présence d’une structure interne, vestige de la coquille, un résidu coquillier.
- Elles vivent entre 2000 et 4000m de profondeur
(Voss 1988)
Le développement de l’ombelle entre chaque bras leur confère une capacité de capture par ‘filet’. Les proies planctoniques entrent au centre des bras, ne peuvent plus sortir à cause de l’ombelle et se font attraper par les cils.
Ces espèces se propulsent soit par un mouvement proche de celui des méduses, soit par propulsion, soit par le battement de ses nageoires ou par une combinaison des trois (Voss 1988).
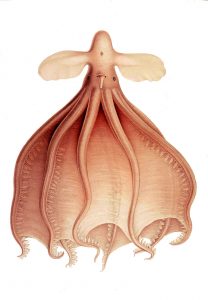
Dessin représentant un cirrate de Murray (Cirrothauma murrayi) découvert par Carl Chun en 1910, illustré dans son livre : Die Cephalopoden
b) Les poulpes des profondeurs
Celles-ci ressemblent généralement à leurs cousins côtiers, la forme reste typique. Ils ont un corps mou, rampent sur le fond ou se propulsent sur de courtes distances.
Dans ces profondeurs, les poulpes, tout comme les requins, sont des composants importants des écosystèmes, car ils ont un rôle écologique dans la structure et la dynamique du réseau trophique. En tant que prédateurs opportunistes avec un large spectre trophique, c’est-à-dire qu’ils sont naturellement liés à une grande variété de proies, ils connectent potentiellement des réseaux trophiques écologiquement distincts (Boyle & Rodhouse 2005 ; Valls et al. 2017).
En exemple, Bathypolypus sponsalis, le poulpe globuleux, se nourrit d’un large choix de crustacés, décapodes, bivalves, gastéropodes et ophiures benthiques, alors que Eledone cirrhosa, le poulpe blanc, préfère se consacrer à la consommation fréquente de vers annélides (Valls et al. 2017). On peut citer le poulpe de Saluzzi, Octopus salutti, ainsi que le poulpe à quatre cornes, Pteroctopus tetracirrhus, qui se contentent de crustacés de fonds (Valls et al. 2017). Se nourrir de proies de fonds va de pair avec leur mode de vie, car les poulpes apprécient les refuges et la cryptie afin de se cacher des prédateurs, ils évitent donc de nager dans la colonne d’eau.
Fait stupéfiant : c’est dans ce groupe que l’on trouve l’espèce qui possède la plus longue période de couvaison des œufs du monde animal : Graneledone boreopacifica (Robison et al. 2014). En effet, ce poulpe des profondeurs couve ses œufs pendant 53 mois, soit plus de 4 ans ! Cette prouesse biologique peut être due à deux facteurs : la basse température et l’avantage sélectif de produire des nouveau-nés très développés (Robison et al. 2014). Cette espèce a été étudiée pour la première fois dans le canyon de Monterey, en Californie, par 1400m de fond.
Dessin représentant le poulpe de Saluzzi par Guiseppe Jatta dans son livre de 1896 : I Cefalopodi viventi nel Golfo di Napoli (sistematica) : monografia
Dessin représentant le poulpe blanc par Guiseppe Jatta dans son livre de 1896 : I Cefalopodi viventi nel Golfo di Napoli (sistematica) : monografia
Un remerciement particulier à Stéphane Jamme et Damien Eloire pour leurs contributions photographiques.
BIBLIOGRAPHIE
Birch J., Burn C., Schnell A., Browning H. & Crump A (2021) Review of the Evidence of Sentience in Cephalopod Molluscs and Decapod Crustaceans. The London of Economics and Political Science.
Boyle P., & Rodhouse P. (2005) Classification of cephalopod families. Ecology and Fisheries, 343.
Certain G., Serazin T., Billet N., & Carrié A. (2021) Éléments de gestion de la pêcherie d’Octopus vulgaris en Occitanie et à travers le monde.
Faraj A., & Bez N. (2007) Spatial considerations for the Dakhla stock of Octopus vulgaris: Indicators, patterns, and fisheries interactions. ICES Journal of Marine Science, 64: 1820–1828.
Garrido D., Varó I., Morales, A. E., Hidalgo M. C., Navarro J. C., Hontoria F., Monroig O., et al. (2017) Assessment of stress and nutritional biomarkers in cultured Octopus vulgaris paralarvae: Effects of geographical origin and dietary regime. Aquaculture, 468: 558–568.
Ishida T. (2021) A model of octopus epidermis pattern mimicry mechanisms using inverse operation of the Turing reaction model. PLoS ONE 16(8): e0256025. https://doi.org/10.1371/journal.pone.0256025
Josef N., Amodio P., Fiorito G., & Shashar N. (2012) Camouflaging in a Complex Environment—Octopuses Use Specific Features of Their Surroundings for Background Matching. PLoS ONE 7(5): e37579. https://doi.org/10.1371/journal.pone.0037579
Levy G., Nesher N., Zullo L., & Hochner B. (2017) Motor control in soft-bodied animals. In: The oxford handbook of invertebrate neurobiology. https://doi.org/10.1093/oxfordhb/9780190456757.013.36
Mereu M., Agus B., Addis P., Cabiddu S., Cau A., Follesa M. C., & Cuccu D. (2015) Movement estimation of Octopus vulgaris (Cuvier, 1797) from mark recapture experiment. Journal of Experimental Marine Biology and Ecology, 470: 64–69.
Messenger J., Cornwell C., & Reed C. (1997) L-Glutamate and serotonin are endogenous in squid chromatophore nerves. J Exp Biol. Dec;200 (Pt 23):3043-54. PMID: 9359893.
Pierce G. J., Allcock L., Bruno I., Bustamante P., Gonzalez A., Guerra A., … & Villanueva R. (2010) Cephalopod biology and fisheries in Europe. ICES.
Robin J. P., Roberts M., Zeidberg L., Bloor I., Rodriguez A., Briceo F., Downey N., et al. (2014) Transitions during cephalopod life history: The role of habitat, environment, functional morphology and behaviour. 361–437 pp.
Robison B., Seibel B., & Drazen J. (2014) Deep-Sea Octopus (Graneledone boreopacifica) Conducts the Longest-Known Egg-Brooding Period of Any Animal. PLoS ONE 9(7): e103437. https://doi.org/10.1371/journal.pone.0103437
Sobrino I., Rueda L., Tugores M. P., Burgos C., Cojan M., & Pierce G. J. (2020) Abundance prediction and influence of environmental parameters in the abundance of Octopus (Octopus vulgaris Cuvier, 1797) in the Gulf of Cadiz. Fisheries Research, 221, 105382.
Strugnell J., Nishiguchi M. K. (2007) Molecular phylogeny of coleoid cephalopods (Mollusca: Cephalopoda) inferred from three mitochondrial and six nuclear loci: a comparison of alignment, implied alignment and analysis methods. Journal of Molluscan Studies, Volume 73, Issue 4, Pages 399–410, https://doi.org/10.1093/mollus/eym038
Valls M., Rueda L., & Quetglas A. (2017) Feeding strategies and resource partitioning among elasmobranchs and cephalopods in Mediterranean deep-sea ecosystems. Deep Sea Research Part I: Oceanographic Research Papers, 128, 28-41.
Von Boletzky S. (1999) Brève mise au point sur la classification des céphalopodes actuels. Bull. Soc. Zool. Fr., 124(3) : 271-278.
Voss G. L. (1988) The biogeography of the deep-sea octopoda. Malacologia, 29(1): 295-307.
Whalen C.D. & Landman N.H. (2022) Fossil coleoid cephalopod from the Mississippian Bear Gulch Lagerstätte sheds light on early vampyropod evolution. Nat Commun 13, 1107. https://doi.org/10.1038/s41467-022-28333-5
Young J. Z. (1971) The anatomy of the nervous system of Octopus vulgaris. Oxford University Press, Oxford
Zullo L., Eichenstein H., Maiole F., & Hochner B. (2019) Motor control pathways in the nervous system of Octopus vulgaris arm. Journal of Comparative Physiology A, 205(2), 271-279.